Kimia > Materi Kimia > Struktur Atom
Kali ini kita akan membahas tentang Struktur dan Perkembangan Teori Atom.
Awal mula teori atom berasal dari pendugaan terhadap atom tersebut. Itu didapatkan terlintas dari pertanyaa ''Apakah ada suatu penyusun pada benda itu?. Dari itu pula di beri nama atom yaitu suatu yang tidak dapat dibagi-bagi, dan sebagai penyusun suatu benda termasuk kita. Untuk lebih jelasnya simakalah artikel di bawah ini;
Rumusan Teori Atom Dalton
Teori yang berkembang pada itu adalah teori atom Dalton oleh John Dalton seorang guru SMU di Manchester, Inggris. Dalton merumuskan teorinya yang dikenal dengan Teori Atom Dalton. Rumusan Dalton yaitu:
1. Unsur Atom yang tidak dapat dibagi, tidak dapat diciptakan, dihancurkan atau diubah menjadi jenis unsur yang lain.
2. Semua unsur atom yang sejenis adalah sama oleh karena itu memiliki sifat yang sama juga.
3. Unsur Atom yang berbeda jenis memiliki sifat-sifat yang berbeda juga.
4. Senyawa adalah 2 atau lebih atom yang bergabung
5. 2 Unsur atom atau lebih dapat direaksikan dalam perbandingan-perbandingan yang berbeda untuk menghasilkan lebih dari 1 jenis senyawa.
Kelemahan Teori Atom Dalton.
Teori atom Dalton dapat menjelaskan Hukum Kekekalan Massa dan Hukum Perbandingan Tetap dengan baik. Diantata 5 teori itu terdapat 2 yang tertolak terutama pada nomer 1 dan nomer 2. Namun demikian, teori tersebut juga mempunyai beberapa kelemahan di antaranya:
Kali ini kita akan membahas tentang Struktur dan Perkembangan Teori Atom.
Awal mula teori atom berasal dari pendugaan terhadap atom tersebut. Itu didapatkan terlintas dari pertanyaa ''Apakah ada suatu penyusun pada benda itu?. Dari itu pula di beri nama atom yaitu suatu yang tidak dapat dibagi-bagi, dan sebagai penyusun suatu benda termasuk kita. Untuk lebih jelasnya simakalah artikel di bawah ini;
Rumusan Teori Atom Dalton
Teori yang berkembang pada itu adalah teori atom Dalton oleh John Dalton seorang guru SMU di Manchester, Inggris. Dalton merumuskan teorinya yang dikenal dengan Teori Atom Dalton. Rumusan Dalton yaitu:
1. Unsur Atom yang tidak dapat dibagi, tidak dapat diciptakan, dihancurkan atau diubah menjadi jenis unsur yang lain.
2. Semua unsur atom yang sejenis adalah sama oleh karena itu memiliki sifat yang sama juga.
3. Unsur Atom yang berbeda jenis memiliki sifat-sifat yang berbeda juga.
4. Senyawa adalah 2 atau lebih atom yang bergabung
5. 2 Unsur atom atau lebih dapat direaksikan dalam perbandingan-perbandingan yang berbeda untuk menghasilkan lebih dari 1 jenis senyawa.
Kelemahan Teori Atom Dalton.
Teori atom Dalton dapat menjelaskan Hukum Kekekalan Massa dan Hukum Perbandingan Tetap dengan baik. Diantata 5 teori itu terdapat 2 yang tertolak terutama pada nomer 1 dan nomer 2. Namun demikian, teori tersebut juga mempunyai beberapa kelemahan di antaranya:
- tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan unsur yang lain.
- tidak dapat menjelaskan sifat listrik materi,
- tidak dapat mejelaskan cara atom-atom saling berkaitan.
Kelemahan-kelemahan seperti yang dikemukakan di atas terpecahkan setelah percobaan-percobaan lebih lanjut yang dilakukan Thomson menunjukkan bahwa atom bukanlah sesuatu yang tidak terbagi, melainkan terdiri atas beberapa jenis partikel subatom. Tiga Sub-atom diantaranya adalah proton, elektron, neutron.
Penemuan Elektron dan Teori Atom Thomson
Pada tahun 1900 teori atom makin berkembang dan berkat jasa dari seorang ilmuwan Joseph John Thomson. Joseph John Thomson lahir di Cheethan Hill, Inggris. Thomson adalah seorang professor fisika eksperimental di Laboratorium Carendish, Cambridge, London. Thomson mendapatkan hadiah nobel fisika tahun 1906 atas penemuan teori atomnya. yah .. itu biografi singkat dari seorang Thomson.
Tahun 1900 Thomson melakukan penelitan fisikanya tentang struktur atom dan menemukan elektron. Penemuan elektron didapatkan dari percobaan-percobaan tentang hantaran listrik melalui tabung hampa. Ingat gas pada tekanan normal bukanlah penghantar listrik. Itulah sebabnya kita tidak terkena sengatan listrik ketika melintas di bawah kabel listrik tegangan tinggi. Conthonya Pada kondisi awan mendung terjadi tekanan udara yang sangat tinggi di udara yang menyebabkan petir. Tetapi, tidak untuk tekanan normal pada kondisi awan yang masih putih.
Pada tahun 1900 teori atom makin berkembang dan berkat jasa dari seorang ilmuwan Joseph John Thomson. Joseph John Thomson lahir di Cheethan Hill, Inggris. Thomson adalah seorang professor fisika eksperimental di Laboratorium Carendish, Cambridge, London. Thomson mendapatkan hadiah nobel fisika tahun 1906 atas penemuan teori atomnya. yah .. itu biografi singkat dari seorang Thomson.
Tahun 1900 Thomson melakukan penelitan fisikanya tentang struktur atom dan menemukan elektron. Penemuan elektron didapatkan dari percobaan-percobaan tentang hantaran listrik melalui tabung hampa. Ingat gas pada tekanan normal bukanlah penghantar listrik. Itulah sebabnya kita tidak terkena sengatan listrik ketika melintas di bawah kabel listrik tegangan tinggi. Conthonya Pada kondisi awan mendung terjadi tekanan udara yang sangat tinggi di udara yang menyebabkan petir. Tetapi, tidak untuk tekanan normal pada kondisi awan yang masih putih.
Namun, pada tahun 1821, Sir Humphry Davy, seorang ahli fisika dari inggris, menemukan bahwa gas menjadi penghantar yang lebih baik pada tekanan rendah. Dari itu Thomson melakukan penelitiannya dengan menggunakan tabung hampa yang disebut tabung pengawanmuatan (discharge tube).
Untuk memahami percobaan tabung sinar katoda dapa dilihat di bawah ini;
 |
| Tabung Sinar Katoda |
Hakikat sinar katode menjadi jelas setelah percobaan yang dilakukan oleh J.J. Thomson pada tahun 1897. Berdasarkan besarnya simpangan sinar katode dalam medan listrik, Thomson dapat menentukan nisbah muatan terhadap massa (nilai e/m) dari partikel sinar katode sebesar 1,76 X 108 C/g.
Selanjutnya, Thomson menemukan bahwa partikel sinar katode, yang kemudian dinamakan elektron. Berdasarkan hal itu, Thomson menyimpulkan bahwa eletron merupakkan partikel dasar penyusun atom.
Percobaan Tetes Minyak Milikan
Setelah harga e/m untuk elektron diketahui melalui percobaan yang dilakukan oleh Thomson, selanjutnya diperlukan percobaan lain untuk menentukan nilai e atau m. Jika salah satu nilai itu dapat diketahui, maka nilai yang satu lagi dapat ditentukan. Seperti halnya matematika jika
a x b = ab jika ab/a = b.
e/m = e x m
yang telah diketahui oleh Thomson massa partikel sinar katode e = 1,76 x 108 C g-1. Jadi, jika kita mengetahui salah satunya massa eletron (m) atau muatan elektron (e) maka kita mengetahui satunya juga
Contoh :
Rumus mencari massa =
m = (e/m) x e
Rumus mencari muatan =
e = (e/m) x m
Pada tahun 1909, Robert Andrews Milikan dari Universitas Chicago, dapat memecahkahkan dilema tersebut melalui percobaan yang dikenal dengan percobaan tetes minyak. Melalui percobaan ini, Milikan dapat menentukan muatan elektron.
a x b = ab jika ab/a = b.
e/m = e x m
yang telah diketahui oleh Thomson massa partikel sinar katode e = 1,76 x 108 C g-1. Jadi, jika kita mengetahui salah satunya massa eletron (m) atau muatan elektron (e) maka kita mengetahui satunya juga
Contoh :
Rumus mencari massa =
m = (e/m) x e
Rumus mencari muatan =
e = (e/m) x m
Pada tahun 1909, Robert Andrews Milikan dari Universitas Chicago, dapat memecahkahkan dilema tersebut melalui percobaan yang dikenal dengan percobaan tetes minyak. Melalui percobaan ini, Milikan dapat menentukan muatan elektron.
Untuk memahami percobaan tetes minyak milikan dapat dilihat di bawah ini;
 |
| Percobaan Tetes Minyak Milikan |
Percobaan tetes minyak dilakukan sebagai berikut.
- Dengan menggunakan alat penyemprot, minyak disemprotkan sehingga membentuk tetesan-tetesan kecil. Sebagian tetes minyak akan melewati lubang pada pelat atas dan jatuh karena tarikan gravitasi.
- Dengan meggunakan teropong, diameter tetes minyak dapat ditentukan sehingga massa tetes minyak dapat diketahui.
- Radiasi sinar X akan mengionkan gas di dalam silinder. Ionisasi akan menghasilkan elektron. Elektron tersebut akan melekat pada tetes minyak sehingga tetes-tetes minyak menjadi bermuatan listrik negatif. Ada yang menyerap satu, dua, atau lebih elektron. Jika pelat logam tidak diberi beda potensial, tetes-tetes minyak tetap jatuh karena pengaruh gravitasi.
- Jika pelat logam diberi beda potensial dengan pelat bawah sebagai kutub negatif, maka tetes minyak yang bermuatan negatif akan mengalami gaya tolak listrik. Sesuai dengan hukum Coulomb, tetes minyak yang mengikat lebih banyak elektron akan tertolak lebih kuat. Pergerakan tetes minyak dibuat mengambang. Dalam keadaan seperti itu berarti gaya tarik gravitasi sama dengan gaya tolak listrik.
- Dengan mengetahui massa tetes minyak dan beda potensial yang digunkan, maka muatan tetes minyak dapat ditentukan.
Melalui percobaan tersebut, Milikan menemukan bahwa muatan tetes-tetes minyak selalu merupakan kelipatan bulat dari suatu muatan tertentu, yaitu 1,602 x 10^-19 coulomb. Milikan menyimpulkan bahwa muatan tersebut adalah muatan dari satu elektron. Perbedaan muatan antar tetesan terjadi karena satu tetesan dapat mengikat 1, 2, 3, ata lebih elektron.
Kalau kurang jelasnya begini biar jelasnya;
suatu muatan 1,602 x 10-19 Coulomb
kelipatannya terjadi adalah:
1,602 x 109 Coulomb x 1 = 1,602 x 10-19 Coulomb (Satu Elektron)
1,602 x 109 Coulomb x 2 = 3,204 x 10-19 Coulomb (Dua Elektron)
1,602 x 109 Coulomb x 3 = 4,806 x 10-19 Coulomb (Tiga Elektron)
1,602 x 109 Coulomb x 4 = 6,408 x 10-19 Coulomb (Empat Elektron)
1,602 x 109 Coulomb x 5 = 8,040 x 10-19 Coulomb (Lima Elektron)
Dan seterusnya. Ingat jika percobaan dari milikan angka yang dihasilkan 1,000 x 10-19 Coulomb. maka dugaan dari milikan salah.
Dari ini milikan mendapatkan nilai dari muatan elektron dan massa eletronnya dengan menggunakan rumus di bawah ini untuk menentukan massa elektronnya;
m = (e/m) x e
m = 1,76 x 108 C gram-1 : 1,602 x 10-19 C = 9, 11 x 10-28 gram.
Jadi massa elekron adalah 9, 11 x 10-28 gram.
Kalau kurang jelasnya begini biar jelasnya;
suatu muatan 1,602 x 10-19 Coulomb
kelipatannya terjadi adalah:
1,602 x 109 Coulomb x 1 = 1,602 x 10-19 Coulomb (Satu Elektron)
1,602 x 109 Coulomb x 2 = 3,204 x 10-19 Coulomb (Dua Elektron)
1,602 x 109 Coulomb x 3 = 4,806 x 10-19 Coulomb (Tiga Elektron)
1,602 x 109 Coulomb x 4 = 6,408 x 10-19 Coulomb (Empat Elektron)
1,602 x 109 Coulomb x 5 = 8,040 x 10-19 Coulomb (Lima Elektron)
Dan seterusnya. Ingat jika percobaan dari milikan angka yang dihasilkan 1,000 x 10-19 Coulomb. maka dugaan dari milikan salah.
Dari ini milikan mendapatkan nilai dari muatan elektron dan massa eletronnya dengan menggunakan rumus di bawah ini untuk menentukan massa elektronnya;
m = (e/m) x e
m = 1,76 x 108 C gram-1 : 1,602 x 10-19 C = 9, 11 x 10-28 gram.
Jadi massa elekron adalah 9, 11 x 10-28 gram.
c. Teori Atom Thomson
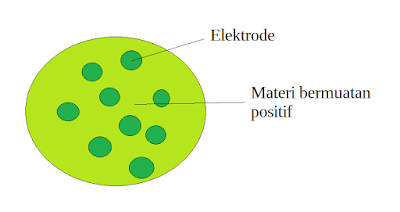 |
| Model Atom Thomson |
Menurut Thomson, atom terdiri dari materi bermuatan positif dan di dalamnya tersebar elektron bagaikan kismis dalam roti kismis. Secara keseluruhan, atom bersifat netral.
Penemuan-Penemuan Model atom yang di ajukan Thomson hanyalah dugaan dan masih bisa di benarkan dan diubah teorinya sesuai pada tingakatan pengetahuan manusia.















0 komentar:
Post a Comment