Kimia > Materi Kimia > Struktur Atom
Kali ini akan membahas tentang perkembangan teori atom modern. Pada awal Atom dikemukakan oleh Dalton. Dalton mengajukan Model atom berbentuk kismis dan elektron bertebaran tanpa adanya sebuah lintasan untuk elektron bergerak dan berputar. Perkembangan Teori atom semakin sempurna dengan berbagai penemuan-penemuan oleh Dalton, Thomson, Rutherford. Dan sekaran akan mempelajari tentang model Niels Bohr dan Mekanika Kuantum (Teori Atom Modern). Langsung saja kita simak bersama-sama artikel di bawah ini;
Teori Atom Niels Bohr
 |
| Niels Bohr |
Salah satu kelemahan teori atom Rutherford adalah bahwa teorinya tidak menjelaskan mengapa elektron tidak tersedot dan jatuh ke intinya. Menurut hukum fisika klasik, gerakan elektron mengitari inti akan disertai pemancaran energi berupa radiasi elektromagnet. Jika demikian, maka energi elektron akan semakin berkurang sehingga gerakannya akan melambat. Sementara, jika gerakan elektron melambat, maka lintasannya akan berbentuk spiral dan akhirnya ia akan jatuh ke inti atom.
Pada tahun 1913, berdasarkan analisis spektrum atom, Niels Bohr mengajukan model atom sebagai berikut.
1. Dalam atom terdapat lintasan-lintasan tertentu tertentu tempat elektron dapat mengorbit inti tanpa disertai pemancaran atau penyerapan energi. Lintasan itu, yang juga disebut kulit atom, adalah orbit berbentuk lingkaran dengan jari-jari tertentu. Tiap lintasan ditandai dengan satu bilangan bulat yang disebut bilangan kuantum utama (n), mulai dari 1, 2, 3, 4, 5dan seterusnya, yang dinyatakan dengan lambang K, L, M, N, O, dan seterusnya. Lintasan pertama, dengan n = 1, dinamai kulit K. Lintasan Kedua, dengan n = 2, dinamai kulit L, dan seterusnya. Makin besar harga n (makin jauh dari inti), makin besar energi elektron yang mengorbit pada kulit itu.
Model atom Niels Bohr dapat menjelasakan kelemahan dari teori atom Rutherford. Namun, pada perkembangan selanjutnya diketahui bahwa gerakan elektron menyerupai gelombang. Oleh karena itu, posisinya tidak dapat ditentukan dengan pasti. Jadi, orbit elektron yang berbentuk lingkaran dengan jari-jari tertentu tidak dapat diterima. Tetapi berbentuk 3 dimensi layaknya tata surya.
Untuk mengetahui Model atom Niels Bohr, lihatlah gambar di bawah ini;
 |
| Model Atom Niels Bohr |
Teori Mekanika Kuantum
 |
| Erwin Schrodinger |
Teori atom mekanika kuantum mempunyai persamaan dengan teori atom Niels Bohr dalam hal tingkat-tingkat energi atau kulit-kulit atom, tetapi berbeda dalam hal bentuk lintasan atau orbit tersebut.
Dalam teori atom mekanika kuantum, posisi elektron adalah tidak pasti. Hal yang dapat ditentukan mengenai keberadaan elektron di dalam atom adalah daerah dengan peluang terbesar untuk menemukan elektron tersebut. Daerah dengan peluang terbesar itu disebut orbital.
Tetapi perumusan dari Erwin Schrodinger sangat susah dipahami oleh ilmuwan pada masa itu. Teori Schrodinger mirip seperti teori tata surya yang orbit peradarannya tidak menentu dan matahari sebagai pusat intinya. Erwin Schrodinger mendapatkan nobel fisika sebagai pengemuka teori mekanika kuantum tahun 1933.
Tetapi perumusan dari Erwin Schrodinger sangat susah dipahami oleh ilmuwan pada masa itu. Teori Schrodinger mirip seperti teori tata surya yang orbit peradarannya tidak menentu dan matahari sebagai pusat intinya. Erwin Schrodinger mendapatkan nobel fisika sebagai pengemuka teori mekanika kuantum tahun 1933.
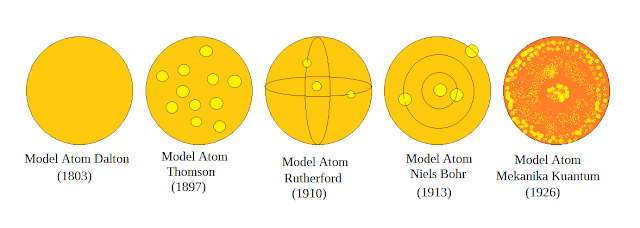 |
| Perkembangan Teori Atom |













0 komentar:
Post a Comment